2023年,本号曾汇总了FDA已获批的免疫检查点PD-1/PD-L1抑制剂的获批情况及适应症,包括:
PD-1抑制剂:
- 可瑞达® 帕博利珠单抗(KEYTRUDA® pembrolizumab)
- 欧狄沃® 纳武利尤单抗(OPDIVO® nivolumab)
- LIBTAYO® cemiplimab
- JEMPERLI® dostarlimab
- ZYNYZ® retifanlimab
PD-L1抑制剂:
- 泰圣奇® 阿替利珠单抗(TECENTRIQ® atezolizumab)
- 英飞凡® 度伐利尤单抗(IMFINZI® durvalumab)
- BAVENCIO® avelumab
时隔两年,这些药物的适应症均有所扩展,并且又有两款新药获得FDA批准上市,分别是:
百泽安® 替雷利珠单抗(Tevimbra® Tislelizumab)
由百济神州自主开发的一款PD-1抑制剂单克隆抗体。该药物最早于2019年在国内上市,经过五年的出海努力,于2024年3月获得美国FDA批准上市,成为首个获FDA批准的国产PD-1药物。
UNLOXCYT® Cosibelimab
由Checkpoint Therapeutics公司研发的PD-L1抑制剂,2024年12月获FDA批准上市,目前尚未在国内申报。
后台有多位小伙伴询问是否有更新,现重新整理相关内容。
1、作用机制
关于PD-1/PD-L1靶点的抗肿瘤机制,大家可以出门左转,参见我之前的内容。
记住所有FDA生物药 | 免疫检查点PD-1/PD-L1抑制剂 | 帕博利珠,纳武利尤,阿替利珠,度伐利尤单抗等
2、适应症
免疫治疗的核心思想是重新激活机体自身的免疫系统来抵抗肿瘤细胞。
因此免疫治疗理论上可以不限癌种,识别并攻击多种肿瘤细胞,达到抑制肿瘤生长和扩散的目的。
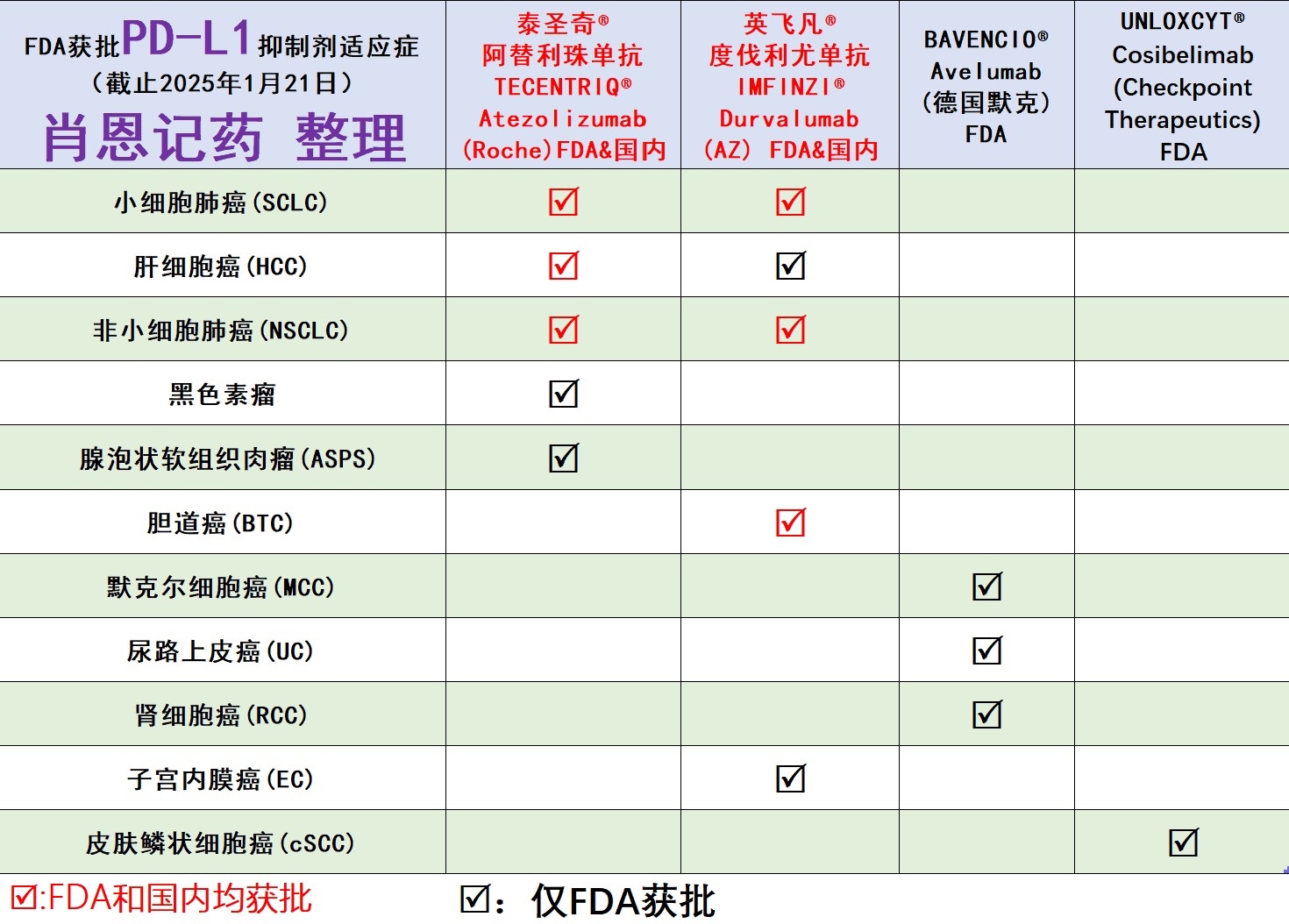
现将截止2025年1月21日,FDA已经获批的PD-1和PD-L1药物的适应症总结如下:
PD-1抑制剂FDA适应症:

PD-L1抑制剂FDA适应症:


牛13